Bibliographie
ce que les scientifiques disent de la décompression
1. Relation entre bulles et accidents de décompression
Introduction
Il est communément admis que les bulles formées dans les différentes parties du corps lors d’une décompression peuvent être pathogènes et peuvent générer différentes formes d’accident de décompression (ADD). Les bulles circulantes, détectables au niveau des vaisseaux sanguins, si elles ne représentent qu’une partie de la production globale des bulles générées par l’organisme reflètent cependant un stress physiologique. Elles jouent un rôle dans de nombreux mécanismes d’ADD et sont liées à divers phénomènes biochimiques associés à la survenue des ADD (interactions bulle / sang) ainsi qu’à des lésions et des dysfonctions de l’endothélium vasculaire [1]. D’une manière consensuelle, une surcharge du filtre pulmonaire par des bulles n’est jamais le signe d’une décompression sûre. Pour l’ensemble de ces raisons, la détection de bulles s’est progressivement développée avec pour objectif de mieux évaluer l’adéquation des procédures de décompression à leurs utilisateurs [2].
Revue de la littérature
S’il n’y a pas de preuve tangible d’une relation de cause à effet entre la quantité de bulles circulant dans la circulation sanguine et l’apparition d’un ADD, de nombreuses études Doppler et d’imagerie ultrasonore ont mis en évidence l’existence d’une association entre les bulles veineuses et le risque d’accident [3] à [15].
L’analyse des performances relatives des méthodes de détection de bulles par Doppler et par imagerie ultrasonore n’a pas mis en évidence de différence significative entre ces méthodes (études réalisées sur des plongeurs au repos) [16].
La variabilité interindividuelle vis-à-vis de la production de bulles détectables est importante [17]. De plus, il semble que les plongeurs ayant des antécédents d’ADD semblent plus enclins à produire des bulles détectables que les plongeurs sans antécédent d’accident [18]. Cependant, des niveaux élevés de bulles peuvent être supportés par des plongeurs sans symptôme d’ADD [19] [20].
En effet, il est désormais largement admis que les bulles circulantes possèdent une valeur prédictive faible vis-à-vis des accidents (faible spécificité), mais que l’absence de bulle est en revanche un bon indicateur de la sécurité d’une décompression (haute sensibilité) [21] [22].
C’est pourquoi la quantité de bulles détectées est considérée comme un indicateur de stress de décompression utile pour comparer les procédures de décompression ou contrôler leur efficacité [2] [23] [24]. Par exemple, le Defence and Civil Institute of Environmental Medicine (DCIEM, maintenant DRDC – Toronto Research Centre) a utilisé pendant des décennies la méthode par ultrasons Doppler pour détecter les bulles circulantes et élaborer de multiples tables de décompression pour la Marine Canadienne [25] à [28]. La valeur ajoutée de la détection de bulles en tant que méthode pour évaluer la pertinence des procédures de décompression a été mise en évidence par des approches statistiques modernes [22] [29] [30]. Elle offre des possibilités intéressantes et rend possible – en termes de coût, de temps, de pertinence statistique et de contrôle du niveau de sécurité – la validation des profils de décompression pour tendre vers une valeur de risque d’ADD donnée.
Discussion
Bien que les outils statistiques et la détection des bulles se soient révélés utiles, ils restent caractérisés par certaines limites : l’approche probabiliste est une méthode a priori qui ne prend pas en compte la variabilité inter / intra individuelle en ce qui concerne la sensibilité aux accidents tandis que l’approche de détection des bulles est une méthode a posteriori qui ne prend pas en compte le profil de pression / profil de décompression pour évaluer le risque d’ADD. Cependant, il est bien connu que la formation de bulles et l’occurrence d’un accident dépendent principalement de l’exposition (profondeur, durée, gaz respiré), de la procédure de décompression (taux de remontée, paliers de décompression, oxygène pendant les paliers) et des caractéristiques physiques du plongeur (âge, indice de masse corporelle IMC). Une analyse approfondie d’un grand ensemble de données utilisant une méthode de régression logistique a montré que l’association entre les forts nivaux de bulles et l’augmentation de la probabilité d’ADD est améliorée après avoir pris en compte les paramètres de plongée, tels que la profondeur, le temps de fond et le temps de décompression, et les covariables individuelles telles que l’âge et l’IMC [31]. Les limites des approches reliant directement les grades de bulles au risque d’ADD ont d’ailleurs été discutées [32]. Dans cette dernière étude, la nature des profils expérimentaux a été présentée comme jouant un rôle déterminant dans la probabilité d’occurrence d’un accident.
La détection par ultrasons de bulles dans la région précordiale (PRE) est couramment utilisée dans l’évaluation du stress de décompression. Bien que la détection de bulles sous-clavière (SC) puisse également être utilisée pour augmenter et améliorer l’évaluation, une étude récente a comparé les grades de bulles au niveau des deux sites comme indicateurs de stress de décompression. Il a été prouvé que l’association des grades de bulles avec les cas d’accidents est plus forte dans le cadre de la mesure SC que pour PRE lorsque la sévérité de l’exposition est prise en compte [33]. L’utilité des mesures en région SC pour l’évaluation de la qualité d’une décompression a donc été sous-estimée dans le passé.
Conclusion
La détection de bulles ne peut pas être utilisée pour prévenir ou prédire l’occurrence d’ADD en temps réel car la spécificité des bulles concernant le risque d’accident est faible. Cependant, il a été montré que pour une même sévérité d’exposition* (*ratio entre profondeur, durée et durée totale de remontée), le rapport de risque entre une plongée générant un grade de bulle élevé et une plongée générant un faible grade de bulle est important [33].
Ainsi, il est très probable qu’une production routinière de grandes quantités de bulles chez un même individu augmente le risque d’ADD de manière significative par rapport à une faible production de bulles.
La détection de bulles constitue donc un outil intéressant pour aider le plongeur, en l’orientant vers une pratique plus sûre, en mettant en évidence des choix alternatifs qui peuvent conduire à diminuer sa production de bulles (palier supplémentaire, utilisation d’oxygène lors des derniers paliers, utilisation du nitrox, utilisation de l’hélium, choix des gradient factors GF) et à la contrôler dans le temps.
Références
- Møllerløkken A, Gaustad SE, Havnes MB, Gutvik CR, Hjelde A, Wisloff U, Brubakk AO. Venous gas embolism as a predictive tool for improving CNS decompression safety. European Journal of Applied Physiology. 2012; 112:401–409. – FULL TEXT
- Nishi RY, Brubakk AO, Eftedal OS. Bubble detection. In: Brubakk AO, Neuman TS, editors. Bennett and Elliott’s physiology and medicine of diving, 5th ed. London: WB Saunders; 2003. p. 501–29.
- Spencer MP, Johanson DC. Investigation of new principles for human decompression schedules using the Doppler ultrasonic blood bubble detector. Tech Report to ONR on Contract N00014-73-C-0094. Seatlle, WA: Institute for Environmental Medicine and Physiology; 1974. – FULL TEXT
- Nashimoto I, Gototh Y. Ultrasonic Doppler detection of blood bubbles in caisson work. In: Pearson R, editor. Early diagnosis of decompressions. Proceedings of the Twelfth Undersea Medical Society Workhsop. UMS 7-30-77. Bethesda MD: Undersea Medical Society; 1977. p. 171–83.
- Nashimoto I, Gotoh Y. Relationship between precordial Doppler ultrasound records and decompression sickness. In: Shilling CW, Beckett MW, editors. Underwater physiology VI: Proceedings of the Sixth Symposium on Underwater Physiology. Bethesda, Maryland: Federation of American Societies for Experimental Biology; 1978. p. 497–501.
- Powell MR, Johanson DC. Ultrasound monitoring and decompression sickness. In: Shilling CW, Beckett MW, editors. Underwater physiology VI: Proceedings of the Sixth Symposium on Underwater Physiology. Bethesda, Maryland: Federation of American Societies for Experimental Biology; 1978. p. 503–10.
- Gardette B. Correlation between decompression sickness and circulating bubbles in 232 divers. Undersea Biomedical Research. 1979; 6:99–107. – ABSTRACT
- Vann RD, Dick AP, Barry PD. Doppler bubble measurements and decompression sickness. Undersea Biomed Res. 1982; 9(Suppl 1): S24. – ABSTRACT
- Eatock BC. Correspondence between intravascular bubbles and symptoms of decompression sickness. Undersea Biomedical Research. 1984; 11:326-9.
- Masurel G. Contribution à l’étude du rôle physiopathologique des bulles générées chez l’animal et chez l’homme par un séjour en atmosphère hyperbare [PhD Thesis]. Lyon, Claude Bernard-Lyon I University; 1987. French.
- Sawatzky KD. The relationship between intravascular Doppler-detected gas bubbles and decompression sickness after bounce diving in humans. M.Sc. Thesis, York University, Toronto; 1991.
- Sawatzky KD. Nishi RD. Intravascular Doppler-detected bubbles and decompression sickness. Undersea and Hyperbaric Medical Society, Inc. Joint Annual Scientific Meeting with the International Congress for Hyperbaric Medicine and the European Undersea Biomedical Society held 11-18 August 1990. Okura Hotel, Amsterdam, The Netherlands. – ABSTRACT
- Conkin J, Powell MR, Foster PP, Waligora JM. Information about venous gas emboli improves prediction of hypobaric decompression sickness. Aviation, Space and Environmental Medicine. 1998; 69:8–16. – ABSTRACT
- Pilmanis AA, Kannan N, Krause KM, Webb JT. Relating venous gas emboli (VGE) scores to altitude decompression sickness (DCS) symptoms. [Abstract]. Aviation, Space and Environmental Medicine. 1999; 70:364.
- Eftedal OS, Lydersen S, Brubakk AO. The relationship between venous gas bubbles and adverse effects of decompression after air dives. Undersea and Hyperbaric Medicine. 2007; 34:99–105. – FULL TEXT
- Brubakk AO, Eftedal O. Comparison of three different ultrasonic methods for quantification of intravascular gas bubbles. Undersea and Hyperbaric Medicine. 2001; 28(3):131–136. – FULL TEXT
- Papadopoulou V, Germonpre P, Cosgrove D, Eckersley RJ, Dayton PA, Obeid G, Boutros A, Tang MX, Theunissen S, Balestra C. Variability in circulating gas emboli after a same scuba diving exposure. European Journal of Applied Physiology. 2018; 118(6):1255–1264. – ABSTRACT
- Gawthrope IC, Summers M, Macey DJ, Playford DA. An observation of venous gas emboli in divers and susceptibility to decompression sickness. Diving and Hyperbaric Medicine. 2015; 45(1):25–29. – FULL TEXT
- Bakovic D, Glavas D, Palada I, Breskovic D, Fabijanic D, Obad A, Valic Z, Brubakk AO, Dujic Z. High-grades bubbles in left and right heart in an asymptomatic diver at rest after surfacing. Aviation, Space and Environmental Medicine. 2008; 79:626-628. – ABSTRACT
- Ljubkovic M, Dujic Z, Møllerløkken A, Bakovic D, Obad A, Breskovic D, Brubakk AO. Venous and arterial bubbles at rest after no-decompression air dives. Medicine & Science in Sports & Exercise. 2011; 43(6):990-995. – ABSTRACT
- Pollock NW. Use of ultrasound in decompression research. Diving and Hyperbaric Medicine. 2007; 37:68–72. – FULL TEXT
- Blogg SL, Møllerløkken A. The use of venous gas emboli to validate dive computers. Proceedings of Validation of Dive Computers Workshop; Blogg SL, Lang MA, Møllerløkken A, editors. European Underwater and Baromedical Society; 2011. p. 93–7. – FULL TEXT
- Jones AD, Miller BG, Colvin AP. Evaluation of Doppler monitoring for the control of hyperbaric exposure in tunneling. Research Report RR598. UK Health and Safety Executive; 2007. – FULL TEXT
- Cooper PD, Van den Broek C, Smart DR, Nishi RY, Eastman D. Hyperbaric chamber attendant safety I: Doppler analysis of decompression stress in multiplace chamber attendants. Diving and Hyperbaric Medicine. 2009; 39:63–70. – FULL TEXT
- Lauckner GR, Nishi RY, Eatock BC. Evaluation of the DCIEM 1983 decompression model for compressed air diving (series A-F). DCIEM Report n 84-R-72. Downsview, Ontario, Canada: Defence and Civil Institute of Environmental Medicine; 1984. – FULL TEXT
- Lauckner GR, Nishi RY, Eatock BC. Evaluation of the DCIEM 1983 decompression model for compressaed air diving (series G-K). DCIEM Report n 84-R-73. Downsview, Ontario, Canada: Defence and Civil Institute of Environmental Medicine; 1984. – FULL TEXT
- Lauckner GR, Nishi RY, Eatock BC. Evaluation of the DCIEM 1983 decompression model for compressed air diving (series L-Q). DCIEM Report n° 85-R-18. Downsview, Ontario, Canada: Defence and Civil Institute of Environmental Medicine; 1985. – FULL TEXT
- Nishi RY, Eatock BC. The role of ultrasonic bubble detection in table validation. In: Schreiner HR, Hamilton RW, editors. Validation of decompression tables. Proceedings of the 37th Undersea and Hyperbaric Medical Society Workshop, UHMS Publication 74(VAL)1-1-88. Bethesda, MA: Undersea and Hyperbaric Medical Society; 1989. p. 133–7. – FULL TEXT
- Doolette DJ, Gault KA, Gutvik CR. Sample size requirement for comparison of decompression outcomes using ultrasonically detected venous gas emboli (VGE): power calculations using Monte Carlo resampling from real data. Diving and Hyperbaric Medicine. 2014; 44(1): 14–19. – FULL TEXT
- Eftedal OS, Tjelmeland H, Brubakk AO. Validation of decompression procedures based on detection of venous gas bubbles: a Bayesian approach. Aviation, Space and Environmental Medicine. 2007;78:94–9. – ABSTRACT
- Shannon JS. The relationship of inert gas and venous gas emboli to decompression sickness [PhD Thesis]. Durham, NC: Duke University; 2003. – FULL TEXT
- Doolette DJ. Venous gas emboli detected by two-dimensional echocardiography are an imperfect surrogate endpoint for decompression sickness. Diving and Hyperbaric Medicine. 2016; 46(1): 4–10. – FULL TEXT
- Hugon J, Metelkina A, Barbaud A, Nishi R, Bouak F, Blatteau J-E, Gempp E. Reliability of venous gas embolism in the subclavian area for decompression stress assessment following scuba diving. Diving and Hyperbaric Medicine. 2018; 48(3): 132–140. – FULL TEXT
2. Caractéristiques individuelles, bulles circulantes et risque d’accident de décompression
Introduction
Les accidents de décompression constituent un risque significatif pour la sécurité et la santé des plongeurs. Ils proviennent de la formation et de la croissance de microbulles de gaz dans les tissus et le sang du plongeur pendant et après la décompression. L’exposition du corps du plongeur à un environnement hyperbare, associée à la respiration de gaz inertes et à une variation de la pression ambiante sont à l’origine des accidents de décompression (ADD). Les conséquences des ADD sont diverses en gravité, allant de simples démangeaisons cutanées à des troubles neurologiques majeurs. En plongée récréative, l’incidence rapportée d’ADD est de 3-4 cas pour 10 000 plongées, dont 50% environ de type neurologique [1]. Les mécanismes pathologiques menant à l’ADD ne sont pas entièrement compris : le risque dépend non seulement de l’exposition (profil de plongée, gaz respirés, conditions environnementales), mais aussi d’une prédisposition du plongeur, influencée par ses caractéristiques physiologiques. Ces dernières sont observables dans la variabilité inter-individuelle et intra-individuelle à la production de bulles circulantes après des expositions quasiment identiques [2].
Le Divers Alert Network (DAN) accumule des données (DAN DB) de plongées récréatives avec des informations liées aux plongeurs et aux plongées. Récemment, sur la base de ces données, une étude épidémiologique sur les facteurs qui influencent le risque d’ADD et la production de bulles après la plongée a été menée [3]. Elle a inclus 39 000 plongées à l’air ou au nitrox en circuit ouvert, dont 970 plongées suivies de mesures de bulles circulantes veineuses après la plongée et 320 ayant entraîné un ADD. Les résultats ont confirmé les résultats de petites études contrôlées et d’une étude épidémiologique antérieure des facteurs de risque d’ADD concernant 458 000 plongées [4]. Les facteurs détaillés ci-dessous, sont considérés comme importants pour une meilleure gestion du risque d’ADD. Il est préconisé de les prendre en compte lors de la planification de plongées, notamment vis-à-vis du choix d’un niveau de conservatisme des procédures de décompression (au niveau individuel ou du groupe).
Revue de la littérature
A la fois la quantité de bulles générées par une plongée et le risque d’ADD augmentent avec l’âge [3] [5] [6] [7], ce qui est confirmé par une analyse comparative prenant en compte la sévérité de l’exposition [8]. L’effet du vieillissement sur la pathophysiologie de la décompression est complexe et encore peu compris : il peut être lié au développement de problèmes de santé, à des changements physiologiques ou à une diminution de la forme physique.
La différence entre les sexes dans la production de bulles est moins marquée. Une analyse récente n’a pas trouvé de différence [3] (mais leur analyse ignorait les interactions avec d’autres paramètres). Toutefois, quelques études ont montré que les femmes produisent moins de bulles que les hommes, cette tendance ne se confirmant pas lorsqu’elles sont âgées, potentiellement à cause de changements physiologiques liés à la ménopause [5] [6]. Une incidence d’ADD plus élevée chez les femmes que chez les hommes a été constatée [3] [4], mais pas dans toutes les études [9]. L’explication de cette contradiction peut être complexe : non seulement la physiologie, mais les habitudes de plongée et la gestion du risque peuvent être différentes entre les hommes et les femmes. Par exemple, une étude a constaté qu’à un niveau d’expérience égal, moins de femmes rajoutent des paliers supplémentaires [4]. Quand l’expérience de plongée est prise en compte, les femmes ont un risque plus faible que les hommes [4]. De plus, les hommes semblent avoir une tendance à sous-déclarer les symptômes légers d’ADD, ce qui introduit un biais dans l’analyse d’incidence [4]. Concernant les facteurs de risque spécifiques aux femmes, l’effet du cycle menstruel sur la prédisposition à l’ADD est un sujet controversé manquant de données vérifiées [5] [10].
L’indice de masse corporelle (BMI) et le pourcentage de graisses sont des mesures usuelles de surpoids. Le surpoids peut augmenter la quantité totale de gaz inertes dans les tissus du plongeur en raison d’une solubilité accrue de l’azote dans les graisses. Les plongeurs avec un plus grand BMI ou pourcentage de graisses ont une tendance à produire plus de bulles et à avoir une plus grande incidence d’ADD [3] [6], même quand la comparaison tient compte de la sévérité de l’exposition [8]. Toutefois, l’adiposité est fortement corrélée avec l’avancée de l’âge et avec une mauvaise forme physique et il est difficile d’isoler leurs effets respectifs sur les bulles de décompression et sur la prédisposition à l’ADD.
Les plongeurs en bonne forme physique sont plus résistants aux accidents de décompression : en particulier une plus grande capacité aérobique (mesurée par la consommation maximale d’oxygène) semble associée à une plus faible production de bulles [11]. Les plongeurs sont incités à pratiquer une activité physique régulière pour une meilleure utilisation d’oxygène, une meilleure élimination des gaz inertes et pour réduire le risque d’épuisement.
En présence de bulles circulantes dans les veines d’un plongeur après la décompression, le risque d’un ADD neurologique est amplifié si ces bulles arrivent à pénétrer dans la circulation artérielle (artérialisation des bulles) et atteindre des organes centraux comme le cerveau. Des plongeurs peuvent avoir une prédisposition à ce passage artérioveineux : un petit trou dans la paroi qui sépare les ventricules droit et gauche du cœur (foramen ovale perméable, FOP) ou une communication entre les artères et les veines dans les poumons (shunts pulmonaires) [12] [13]. Le rôle d’un FOP dans l’exposition au risque d’ADD a été longtemps débattu dans la littérature [14]. Nous avons donc consacré une revue spéciale à ce facteur important.
Une étude contrôlée sur 400 plongeurs a montré que la déshydratation augmente significativement le risque d’avoir un ADD [15]. Une autre étude sur 9 plongeurs suggère que la réhydratation 90 minutes avant la plongée réduit la formation de bulles et augmente significativement le volume de plasma [16]. Les plongeurs doivent boire suffisamment 1,5-2 heures avant la plongée pour se maintenir correctement hydratés.
Aucune étude épidémiologique n’a déterminé si la consommation d’alcool influence la prédisposition à l’ADD, mais il est connu que la consommation d’alcool avant la plongée augmente la déshydratation qui à son tour mène à une augmentation du risque d’ADD. La consommation d’alcool après la plongée peut provoquer la formation de bulles [17]. Par conséquent, il est conseillé d’éviter l’alcool au moins 12 heures avant la plongée et 2 heures après la plongée.
Concernant le risque associé au tabagisme, les fumeurs présentent généralement des symptômes plus sévères que les non-fumeurs [18].
Conclusion
Les accidents de décompression représentent un phénomène complexe. De nombreux facteurs influencent leur occurrence ; certains sont sous contrôle du plongeur et d’autres ne le sont pas. Beaucoup de ces facteurs sont liés à la fois à l’augmentation de la quantité de bulles circulantes et à l’augmentation du risque d’ADD, ce qui conforte la relation bulles / accident à laquelle nous avons dédié une revue spéciale. Les plongeurs gagnent à connaître ces deux types de facteurs et à en tenir compte lors de la planification de plongées.
La revue de la littérature inviterait donc à émettre les préconisations suivantes :
- Garder une bonne forme physique grâce à un exercice régulier ;
- S’hydrater et éviter l’alcool avant et après la plongée ;
- Éviter de fumer ;
- Adopter des procédures de décompression plus conservatives avec l’avancement de l’âge ;
- Plonger moins profondément et moins longtemps avec des procédures plus conservatives lorsqu’on ne se sent pas en bonne forme.
Références
Buzzacott P., Denoble P.J. (editors). DAN Annual Diving Report 2018 Edition – A report on 2016 diving fatalities, injuries, and incidents, Durham, NC: Divers Alert Network, 2018; pp. 1-112 – FULL TEXT
Papadopoulou V., Germonpré P.,Cosgrove D., Eckersley R.J.,Dayton P.A., Obeid G., Boutros A.,Tang M.-X., Theunissen S., Balestra C., Variability in circulating gas emboli after a same scuba diving exposure, European Journal of Applied Physiology, 2018, vol. 118 (6): pp. 1255–1264. – ABSTRACT
Cialoni D., Pieri M., Balestra C., Marroni A., Dive Risk Factors, Gas Bubble Formation, and Decompression Illness in Recreational SCUBA Diving: Analysis of DAN Europe DSL Data Base, Frotiers in Physiology, 2017, vol. 8, article 1587. – FULL TEXT
Leger Dowse M.St., Bryson A., Gunby A., Fife W., Comparative Data from 2250 Male and Female Sports Divers: Diving Patterns and Decompression Sickness, Aviation, Space and Environmetal Medicine, 2002, vol. 73(8), pp. 743-749. – FULL TEXT
Dunford R.G., Vann R.D., Gerth W.A., Pieper C.F., Huggins K., Wacholtz C., Bennett P.B. The incidence of venous gas emboli in recreational diving, Undersea and Hyperbaric Medicine, 2002, vol. 29(4):pp. 247-59. – FULL TEXT
Boussuges A., Retali G., Bodéré‐Melin M., Gardette B., Carturan D., Gender differences in circulating bubble production after SCUBA diving, Clinical Physiology and Functional Imaging, 2009, vol.29(6): pp. 400-405. – ABSTRACT
Souday V., Koning N.J., Perez B., Grelon F., Mercat A., Boer C., Seegers V., Radermacher P., Asfar P., Enriched Air Nitrox Breathing Reduces Venous Gas Bubbles after Simulated SCUBA Diving: A Double-Blind Cross-Over Randomized Trial, Plos One, 2016, vol. 11(5):e0154761. DOI: 10.1371/journal.pone.0154761. – FULL TEXT
Shannon J.S., The relationship between inert gas and venous gas emboli to decompression sickness, PhD Thesis, Durham, NC, Duke University, 2003. –FULL TEXT
Mirasoglu B, Aktas S. Turkish recreational divers: a comparative study of their demographics, diving habits, health and attitudes towards safety, Diving and Hyperbaric Medicine, 2017, vol.47(3), pp. 173–179. – FULL TEXT
Lee V., St. Leger Dowse M., Edge C., Gunby A., Bryson P. Decompression sickness in women: a possible relationship with the men strual cycle, Aviation, Space and Environmental Medicine, 2003, vol. 74, pp. 1177-82. – ABSTRACT
- Caraturan D., Boussuges A., Vanuxem P., Barhen A., Burnet H., Gardette B., Ascent rate, age, maximal oxygen uptake, adiposity, and circulating venous bubbles after diving, Journal of Applied Physiology, 2002, vol. 93(4), pp. 1349-56. – FULL TEXT
Pollock N.W., Aerobic fitness and underwater diving, Diving and Hyperbaric Medicine, 2007, vol. 37 (3), pp. 117-124. – FULL TEXT
Germonpré P., Dendale P., Unger P., Balestra C. Patent foramen ovale and decompression sickness in sports divers Journal of Applied Physiology, 1998, vol. 84(5): pp. 1622-1626. – FULL TEXT
Madden D., Lozo M., Dujic Z., Ljubkovic M. , Exercise after SCUBA diving increases the incidence of arterial gas embolism, Journal of Applied Physiology, 2013, vol 115(5): pp. 712-722. – FULL TEXT
Denoble P.J., Holm J.R. eds., Patent Foramen Ovale and Fitness to Dive Consensus Workshop Proceedings, Durham, NC, Divers Alert Network, 2015, 160 pp. – FULL TEXT
Gempp E, Blatteau J, Pontier J ., Balestra C., Louge P., Preventive effect of pre-dive hydration on bubble formation in divers, British Journal of Sports and Medicine, 2009, vol. 43, pp. 224-228. – ABSTRACT
Sheldrake S., Pollock N. W, Alcohol and Diving, In: Steller D., Lobel L., eds. Diving for Science 2012, Proceedings of the American Academy of Underwater Sciences 31st Symposium, Dauphin Island, AL: AAUS. – FULL TEXT
Buch D.A., El Moalem H, Dovenbarger J.A., Uguccioni D.M., Moon R.E., Cigarette smoking and decompression illness severity: a retrospective study in recreational divers, Aviation Space and Environmental Medicine, 2003, vol. 74, pp. 1271–1274. – ABSTRACT
Revues particulières
Foramen Ovale Perméable (FOP)
Introduction
Le foramen ovale est un petit trou situé dans le septum, la paroi entre les deux cavités supérieures du cœur. Avant la naissance, les poumons ne sont pas utilisés pour apporter au fœtus du sang riche en oxygène. Le sang enrichi provient du placenta de la mère et est délivré par le cordon ombilical. Le foramen ovale permet à une petite partie du sang veineux de passer directement de l’oreillette droite du cœur du fœtus à l’oreillette gauche du cœur, en contournant les poumons. Normalement, le foramen ovale se ferme lorsque la pression artérielle augmente dans le côté gauche du cœur après la naissance ou quelques années après la naissance. Une fois fermé, le sang dans son ensemble se dirige vers les poumons sans dérivation, pour se charger en oxygène avant qu’il ne pénètre dans le côté gauche du cœur et soit pompé vers le reste du corps.
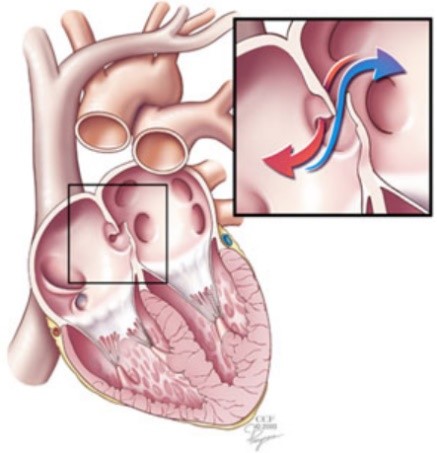
Le foramen ovale reste ouvert, ou perméable (foramen ovale perméable ou FOP), chez environ 25% de la population adulte [1] (1). La plupart des patients atteints de FOP ne présentent aucun symptôme. Cependant, cette configuration anatomique peut jouer un rôle dans les migraines et elle augmente le risque d’AVC, d’ischémie cérébrale transitoire et de crise cardiaque. Chez les plongeurs, elle est parfois associée à des cas d’accident de décompression neurologiques, à des cas d’accident de décompression de l’oreille interne et à des symptômes cutanés [2]. Des bulles provenant du retour veineux, formées pendant et après la décompression, peuvent traverser le shunt du foramen ovale – donc non filtrées par le poumon – et envahir la circulation artérielle périphérique. Elles peuvent atteindre des tissus sursaturés en gaz inertes et, par conséquent, il existe un risque amplifié d’embolie dans ces zones.
Revue de la littérature
La corrélation entre la présence d’un FOP et un risque accru d’occurrence d’une forme grave d’accident de décompression a été évoquée il y a plus de trente ans [3], notamment concernant les formes neurologiques s’instaurant rapidement après le retour en surface [4].
Les différentes formes d’accident de décompression pour lesquelles un lien a été démontré en rapport avec la présence d’un FOP ont été récemment passées en revue [2]. Les accidents cérébraux semblent plus liés à la présence d’un FOP que les accidents médullaires [5]. La corrélation au risque d’accident médullaire est moins marquée mais semble exister [6][7]. Concernant les lésions cérébrales et celles de l’oreille interne, où les niveaux de sursaturation peuvent être localement élevés, des mécanismes ont été proposés et discutés [2] [8]. La relation entre certaines formes d’accidents cutanées et le FOP était initialement plutôt incomprise. Une étude récente a conduit à émettre l’hypothèse d’un mécanisme avec médiation cérébrale [9].
Le ratio de risque d’accident pour un plongeur avec FOP, par rapport à un plongeur sans FOP, n’est pas connu avec précision, mais plusieurs études tendent à indiquer une augmentation du risque, au moins 2.5 fois supérieure [10][11], voire plus de cinq fois supérieure [12] [13]. Les formes sévères d’accident sont nettement plus fréquentes en présence d’un FOP [14]. De plus, il a été prouvé que le ratio de risque d’accident de décompression est aussi lié à la taille du FOP [12] [15]. Dans une étude récente, sur 200 plongeurs qui ont procédé à une fermeture de défaut auriculaire (FOP et CIA) après un accident lié à un shunt, environ 50% avaient un défaut auriculaire de 10 mm ou plus, tandis qu’environ 1% de la population générale semble avoir un diamètre de FOP dans cette fourchette (environ 25% de la population a un FOP mais avec un diamètre principalement compris entre 2 mm et 6 mm) [15]. Néanmoins, les formes graves de d’accident sont parfois associées à des FOP de petite taille [16].
La fermeture du FOP semble être une solution efficace pour limiter fortement le passage de bulles vers le versant artériel [17] et prévenir les accidents majeurs et pouvoir revenir à une pratique de la plongée sans restriction [16] [18], tandis que des profils de plongée plus conservatifs, sans fermeture du FOP, semblent également conduire à un niveau de sécurité satisfaisant vis-à-vis des formes sévères d’accident [18]. Elle est également associée à une diminution des lésions cérébrales asymptomatiques [19]. La chirurgie de fermeture de FOP se caractérise par un faible taux de complications post-opératoires [20].
Discussion
La caractérisation des risques d’accidents liés à une présence de FOP reste un sujet de recherche majeur. Une analyse statistique rigoureuse n’est pas encore disponible. Une manière systématique de dépister le FOP (présence, dimension, ouverture totale, partielle, intermittente…), avec ou sans antécédents d’accident, avec ou sans recourt à des moyens invasifs, n’est pas à ce jour disponible voire souhaitable.
En effet, bien que la communauté scientifique s’accorde toutefois sur le fait que le FOP est un facteur de risque d’accident, un dépistage systématique chez le plongeur n’est pas préconisé [20]. Seuls les plongeurs ayant des antécédents de forme sévère d’accident sont éligibles pour un dépistage de routine, par échocardiographie transthoracique avec manœuvres provocantes vis-à-vis de l’ouverture. En cas de résultat de FOP positif, la fermeture du FOP à l’aide d’un cathéter est recommandée pour le retour à la plongée normale [21].
Cependant, une approche conservatrice de la plongée, avec des profils de plongée moins sévères conduisant à une limitation de la charge de gaz, semble être une alternative intéressante pour limiter le risque d’accident [22].
Enfin, il faut noter que d’autres voies de shunt droite-gauche peuvent exister dans l’organisme, notamment au niveau pulmonaire [23][24], l’impact de l’oxygène et du niveau d’effort sur ce type de shunt ayant été étudié [24][25][26]. Actuellement, le risque d’accident associé à cette réalité anatomique (avec une dispersion vis-à-vis de son importance dans la population) et son rôle dans l’artérialisation des microbulles est mal connu.
References
- Homa S, Messé SR, Rundek T, Sun YP, Franke J, Davidson K, Sievert H, Sacco RL, Di Tullio MR. Patent foramen ovale. Nat Rev Dis Primers. 2016; 2: 15086. – ABSTRACT
- Wilmshurst PT. The role of persistent foramen ovale and other shunts in decompression illness. Diving Hyperb Med. 2015; 45(2):98-104. – FULL TEXT
- Moon RE, Camporesi EM, Kisslo JA. Patent foramen ovale and decompression sickness in divers. Lancet. 1989 Mar 11, 1(8637):513-514. – ABSTRACT
- Wilmshurst PT, Byrne JC, Webb-Peploe MM. Relation between interatrial shunts and decompression sickness in divers. Lancet. 1989 Dec 2, 2(8675):1302-1306. – ABSTRACT
- Germonpré P, Dendale P, Unger P, Balestra C. Patent foramen ovale and decompression sickness in sports divers. Journal of Applied Physiology. 84(5): 1622-1626. – FULL TEXT
- Wilmshurst PT, Bryson P. Relationship between the clinical features of neurological decompression illness and its causes. Clinical Science. 2000; 99:67-75. – FULL TEXT
- Wilmshurst PT. Clinical experience of right-to-left shunts in divers with decompression illness. Patent Foramen Ovale and Fitness to Dive Consensus Workshop, Montreal June 17 2015. pp. 21-33. – FULL TEXT
- Mitchell SJ, Doolette DJ. Pathophysiology of inner ear decompression sickness: potential role of the persistent foramen ovale. Diving Hyperb Med. 2015; 45(2): 105-110. – FULL TEXT
- Kemper TCPM, Rienks R, Van Ooij PJAM, Van Hulst RA. Cutis marmarota in decompression illness may cerebrally mediated: a novel hypothesis on the aetiogoloy of cutis marmarota. Diving Hyperb Med. 2015; 45(2):84-88. – FULL TEXT
- Bove AA. Risk of decompression sickness with patent foramen ovale. Undersea and Hyperbaric Medicine. 1998; 25(3): 175-178. – ABSTRACT
- Germonpre P. Incidence of DCS in divers with RLS – A prospective study. Patent Foramen Ovale and Fitness to Dive Consensus Workshop, Montreal, June 17 2015. pp. 47-58. – FULL TEXT
- Torti SR, Billinger M, Schwerzmann M, Vogel R, Zbinden R, Windecker S, Seiler C. Risk of decompression illness among 230 divers in relation to the presence and size of patent foramen ovale. Eur Heart J. 2004; 25: 1014-1020. – FULL TEXT
- Honek J, Sramek M, Sefc L, Januska J, Fiedler J, Horvath M, Tomak A, Novotny S, Honek T, Veselka J. High-grade patent foramen ovale is a risk factor of unprovoked decompression sickness in recreational divers. J Cardiol. 2019; 74(6): 519-523. –ABSTRACT
- Liou K, Wolfers D, Turner R, Bennett M, Allan R, Jepson N, Cranney G. Patent foramen ovale influences the presentation of decompression illness in SCUBA divers. Heart, Lung and Circ. 2015; 24: 26-31. – FULL TEXT
- Wilmshurst PT, Morrison WL, Walsh KP, Pearson MJ, Nightingale S. Comparison of the size of persistent foramen ovale and atrial septal defects in divers with shunt-related decompression illness and in the general population. Diving Hyperb Med. 2015; 45(2):89-93. – FULL TEXT
- Wilson C, Sayer MDJ. Cerebral arterial gas embolism in a professional diver with a persistent foramen ovale. Diving Hyperb Med. 2015; 45(2): 124-126. – FULL TEXT
- Honek J, Smarek M, Sefc L, Januska J, Fielder J, Horvath M, Tomek A, Novotny S, Honek T, Veselka J. Effect of catheter-based patent foramen ovale closure on the occurrence of arterial bubbles in scuba divers. Journal of The American College of Cardiology Intervention. 2014; 7(4): 403-408. – FULL TEXT
- Koopsen R, Stella PR, Thijs KM, Rienks R. Persistent foramen ovale closure in divers with a history of decompression sickness. Neth Heart J. 2018; 26: 535-539. – FULL TEXT
- Billinger M, Zbinden R, Mordasini R, Windecker S, Schwerzmann M, Meier B, Seiler C. Patent foramen ovale closure in recreational divers: effect on decompression illness and ischaemic brain lesions during long-term follow-up. 2011; 97(23): 1932-1937. – ABSTRACT
- Pearman A, Bugeja L, Nelson M, Szantho GV, Turner M. An audit of persistent foramen ovale closure in 105 divers. Diving Hyperb Med. 2015; 45(2): 94-97. – FULL TEXT
- Smart D, Mitchell S, Wilmshurst P, Turner M, Banham N. Joint position statement on persistent foramen ovale (PFO) and diving. South Pacific Underwater Medicine Society (SPUMS) and the United Kingdom Sports Diving Medical Committee. Diving Hyperb Med. 2015; 45(2): 129-131. – FULL TEXT
- Klingmann C, Rathmann N, Hausmann D, Bruckner T, Kern R. Lower risk of decompression sickness after recommendation of conservative decompression practices in divers with and without vascular right-to-left shunt. Diving Hyperb Med. 2012; 42(3): 146-150. – FULL TEXT
- Lovering AT, Stickland MK, Kelso AJ, Eldridge MW. Direct demonstration of 25 and 50µm arteriovenous pathways in healthy human and baboon lungs. Am J Physiol Heart Circ Physiol. 2007; 292: H1777-H1781. – FULL TEXT
- Lovering AT, Haverkamp HC, Romer LM, Hokanson JS, Eldridge MW. Transpulmonary passage of 99mTc macroaggregated albumin n healthy humans at rest and during maximal exercise. Journal of Applied Physiology. 2009; 106: 1986-1992. – FULL TEXT
- Lovering AT, Romer LM, Haverkamp HC, Pegelow DF, Hokanson JS, Eldridge MW. Intrapulmonary shunting and pulmonary gas exchange during normoxic and hypoxic exercise in healthy humans. Journal of Applied Physiology. 2008; 104: 1418-1425. – FULL TEXT
- Eldridge MW. Inducible intrapulmonary arteriovenous shunt pathways: are they important in DCS?. Patent Foramen Ovale and Fitness to Dive Consensus Workshop, Montreal, June 17 2015. pp. 65-72. – FULL TEXT
(1) In fact, there are two kinds of such holes in the heart. One is called an atrial septal defect (ASD), and the other is a patent foramen ovale (PFO). Although both are holes in the wall of tissue (septum) between the left and right upper chambers of the heart (atria), their causes are quite different. An ASD is a failure of the septal tissue to form between the atria, and as such it is considered a congenital heart defect, something that you are born with. Generally an ASD hole is larger than that of a PFO.
3. Exposition et environnement, bulles circulantes et risque d’accident de décompression
Revues particulières
Paliers profonds
Introduction
Il y a dix ans, DAN a publié un texte (original en anglais) qui résumait parfaitement la problématique des paliers profonds [1] :
« Tout au long de l’histoire, la principale préoccupation des plongeurs a été de savoir comment remonter à la surface sans accident de décompression. Le scientifique britannique J.S. Haldane a combiné des données empiriques avec des études scientifiques pour développer des procédures de décompression étape par étape qui, avec l’expérience et le travail accumulés de nombreux scientifiques, ont conduit au développement de tables de décompression modernes et d’algorithmes informatiques.
Les accidents de décompression surviennent toujours de nos jours chez les plongeurs loisir, mais à raison de 1 à 4 cas pour 10 000 plongées ; ces cas d’accident sont souvent bénins et traitables. Cependant, il existe des cas graves – bien que rares – ce qui laisse les plongeurs assez concernés par toute mesure qui pourrait réduire davantage le risque. Une des possibilités serait le palier profond.
Au milieu des années 1990, Richard Pyle, un scientifique en bio-marine qui plongeait fréquemment à de grandes profondeurs à la recherche d’espèces de poissons, a remarqué qu’il se sentait parfois fatigué après les plongées, et à d’autres moments, il se sentait bien. Excellent observateur et scientifique de formation, il a déduit que lorsqu’il devait s’arrêter pendant son ascension pour dégonfler les vessies natatoires de ses spécimens, il se sentait beaucoup mieux. Aussi, il a introduit un bref arrêt à mi-chemin de la surface sur toutes ses plongées et s’est convaincu que cela réduisait considérablement sa fatigue après la plongée. Il a partagé son expérience avec ses collègues plongeurs, et la pratique des paliers profonds s’est répandue parmi les plongeurs techniques avant de pouvoir être testée scientifiquement.
Qu’est-ce qu’un palier profond ? Dans l’esprit de la plupart des pratiquants, le palier profond est un arrêt supplémentaire pendant la remontée, introduit par les plongeurs au-delà de ce que leur algorithme informatique exige. Cependant, il existe maintenant des algorithmes informatiques qui proposent des paliers profonds, bien que ni ces algorithmes ni la pratique des paliers profonds n’aient été complètement validés.
La discussion sur les paliers profonds n’est pas nouvelle pour les scientifiques qui étudient la sécurité autour de la décompression. Depuis que Haldane a établi pour la première fois des tables de décompression, la profondeur du premier palier a été débattue. Les réponses ont varié au fil du temps, en fonction des pratiques de plongée contemporaines et des préoccupations actuelles. Haldane, par exemple, a supposé que les tissus du corps peuvent maintenir un certain niveau de sursaturation ou une quantité critique de gaz excédentaire avant que les bulles ne se produisent. C’est pourquoi son modèle de décompression a proposé une remontée relativement rapide jusqu’à des profondeurs qui, selon lui, permettent une élimination efficace du gaz inerte.
Plus tard, il est devenu évident que des bulles se forment beaucoup plus tôt que ne le supposait Haldane, et ces résultats ont conduit à la création de « modèles à bulles ». De nombreux ordinateurs de plongée sur le marché intègrent des paliers plus profonds que les modèles Haldaniens précédents. Certains d’entre eux sont basés sur des modèles à bulles, tandis que d’autres ajustent les paramètres des modèles sans bulle pour obtenir des effets similaires. Par ailleurs, pour imiter les pratiques de palier profond adoptées par certains plongeurs techniques, certains ordinateurs ajoutent des paliers plus profonds que ce que leurs algorithmes proposent ou offrent aux plongeurs cette option.
La grande question qui se pose aux plongeurs aujourd’hui est donc : quelle est l’efficacité des paliers profonds vis à vis du risque d’accident, qu’ils soient proposés par un algorithme ou qu’ils soient pratiqués par les plongeurs indépendamment de ce que leurs ordinateurs suggèrent ? »
Ce résumé et les questions soulevées restent d’actualité. Comme cela sera détaillé plus loin, la controverse sur la pertinence des paliers profonds est un débat majeur, soulignant que la théorie de la décompression est toujours un sujet vivant. C’est une question fréquemment discutée dans le domaine de la plongée [2], avec des positions actuellement moins fermes : un compromis doit être trouvé entre tous les points de vue théoriques pour et contre, reflété d’un point de vue pratique par la possibilité d’ajustement des gradient factors (GF).
Revue de la littérature
Au début des années 60, plus de vingt ans avant les observations de Pyle, Brian Hills a analysé les procédures de décompression utilisées par les pêcheurs de perles dans le détroit de Torres et a introduit un nouveau concept de modélisation de la décompression [3]. Ces plongeurs pratiquaient leur premier palier plus profondément que proposés par les tables de l’époque, avec, en outre, un saut de pression plus élevé que la pratique conventionnelle entre le dernier palier et la surface. Le concept de « zéro sursaturation» proposé par Hills suppose que des bulles peuvent se former même pour des niveaux de sursaturation très faibles. Par conséquent, la première partie de la décompression doit être considérablement ralentie avec un premier palier assez profond. Même si le travail de Hills n’a jamais produit de tables de décompression opérationnelles, son approche a inspiré une génération de chercheurs qui s’est concentrée sur la modélisation des bulles et la nécessité de limiter l’amplitude de diminution de la pression ambiante lors de la remontée, afin de limiter la génération et la croissance des bulles [4]. Ils ont revu la théorie de Haldane ou du moins tenté de redéfinir les seuils de sursaturation acceptables. A l’époque, c’était déjà un sujet de recherche très stimulant.
Dans ce contexte, David Yount, de l’Université d’Hawaï, a commencé des travaux fondamentaux sur la décompression à la fin des années 70. L’un de ses objectifs était la sélection de critères de formation de microbulles, dans un milieu en état de sursaturation. Il a supposé que les microbulles se formant dans le corps lors d’une décompression sont produites à partir de micronoyaux préexistants qui sont activés. Yount a ouvert de nouvelles perspectives en étudiant des échantillons de gélatine, comprimés plus ou moins rapidement, saturés d’un gaz inerte puis soumis à décompression. Ses expériences ont permis, pour la première fois, la numération des micronoyaux recrutés et transformés en microbulles sous différents niveaux de sursaturation. Un nouveau modèle de décompression appelé VPM (Varying Permeability Model) a finalement été proposé pour l’Homme, en utilisant ses fondements théoriques [5]. Le modèle VPM, proposé par Eric Maiken et Erik Baker aux Etats-Unis sous la version A puis B, a été largement utilisé par les plongeurs loisir techniques qui plongent assez profondément avec des mélanges trimix et héliox (plongeurs TEK). Il génère des paliers de décompression profonds / courts par rapport aux procédures plus standards car il limite les niveaux de sursaturation pour réduire le nombre de micronoyaux recrutés.
Dans la continuité de l’approche de Yount, Bruce Wienke a proposé au marché de la plongée sous-marine loisir un nouvel algorithme RGBM largement utilisé comme base par plusieurs ordinateurs de décompression des années 90.
Néanmoins, parallèlement aux motivations de modélisation des bulles, les travaux d’Edward Thalmann aux États-Unis pour l’US Navy et ceux d’Albert Bühlmann en Europe n’ont pas réfuté les fondamentaux Haldaniens. En réalité, ils restent aujourd’hui la base de la plupart des tables opérationnelles actuelles pour les plongeurs professionnels et amateurs, et de la plupart des ordinateurs de décompression.
Les algorithmes EL-RTA puis VVAL de Thalmann sont de type néo-Haldanien, avec une cinétique d’échange de gaz linéaire-exponentielle et diverses matrices de tensions tissulaires maximales admissibles (approche M-value Workman). Une désaturation tissulaire plus lente (linéaire) que la phase de saturation (exponentielle) a été introduite, reflétant le fait que la formation de bulles ralentit probablement la cinétique d’élimination des gaz inertes. Ceci a constitué une évolution majeure pour ces modèles néo-Haldaniens, soulignant le fait que des adaptations de l’approche d’origine étaient nécessaires.
Dans le domaine du loisir, les plongeurs TEK, initialement enjoués par le renouveau proposé par les paliers profonds VPM et RGBM, ont finalement largement opté pour l’algorithme Bühlmann ZH-L16, avec l’option des gradient factors (GF). Les plongeurs personnalisent leurs procédures de décompression via les possibilités de réglage pour la profondeur du premier palier (GF Low) et le temps total de décompression (GF High) [6]. La question de la forme de la courbe de décompression apparaît comme un problème central. Ce contexte a motivé plusieurs études pour évaluer la pertinence des paliers profonds.
Dans les années 2000, la Marine nationale a testé quatre protocoles de plongée à l’air à 50m et 60m sur 12 plongeurs avec des profils de remontée expérimentaux (EAP) testés en chambre hyperbare, avec un monitoring des bulles pour évaluer les avantages offerts par les paliers profonds [7] [8]. L’intérêt des paliers profonds n’a pas été démontré, avec trois des procédures EAP ne montrant aucune différence, une ayant produit une augmentation de la production de bulles et une autre ayant généré un cas d’accident articulaire, ce par rapport aux procédures de la Marine nationale MN90 testées conjointement.
Il faut mentionner que les profils de décompression testés par la marine française ne reflétaient pas exactement la pratique des plongeurs techniques (pas figée et claire du tout) ou le protocole de décompression proposé par Richard Pyle [9]. Cette remarque s’applique aux résultats observés par l’US Navy à travers une étude dédiée [10]. Une exposition expérimentale 170fsw / 30min a été testée selon l’algorithme VVAL18 Thalmann d’un côté et selon un modèle de bulle probabiliste (BVM3) produisant des paliers profonds de l’autre côté, avec la même durée de décompression. L’incidence en termes de nombres d’accidents -suivant ces deux procédures- a été comparée. Le taux d’accidents associé aux paliers profonds a été significativement plus élevé que celui de l’approche conventionnelle avec des paliers moins profonds. Il a été déduit que la cinétique des gaz tissulaires est impactée par un palier profond, ce qui est facilement compréhensible si l’on suit une vue Haldanienne (1). Cette étude expérimentale de l’US Navy fait suite à une étude précédente tendant à montrer que l’introduction d’un palier profond limite la production de bulles sur des profils 210fsw/ 50min et 170fsw/ 30min [11].
Une étude plus récente tend à souligner une fois de plus qu’aucun avantage majeur ne se dégage pour un profil avec palier profond par rapport à un profil calculé via l’algorithme de Bühlmann ajusté avec GF, pour une plongée trimix 50m/25min : la production de bulles détectée par échocardiographie 2D n’était pas significativement différente et les paliers profonds ont produit des réponses inflammatoires encore plus marquées [12].
Discussion
En 2008, la communauté scientifique s’accordait à conclure : «Concernant les plongées nécessitant de la décompression, il existe des preuves contradictoires concernant l’efficacité relative des régimes de décompression qui incluent des paliers profonds empiriques ou dérivés de modèles et des régimes de décompression prescrits par des modèles à bulles» [13]. A ce jour, cette conclusion n’a toujours pas été remise en question.
On peut remarquer que la procédure de Pyle, en accord avec les vues théoriques concernant la production de microbulles et la dynamique de croissance, n’a jamais été vraiment testée pour prouver ses avantages par rapport aux procédures plus conventionnelles.
Comme l’a souligné Erik Baker, il existe une possibilité infinie de produire des paliers profonds, même avec une approche néo-Haldanienne, en utilisant un algorithme de Bühlmann modulé avec une option GF [6]. L’introduction des paliers profonds doit être compensée par un allongement du dernier palier près de la surface, vraisemblablement pour permettre l’élimination de la charge de gaz accumulée ou contenue dans certains tissus pendant la période de paliers profonds.
La question de l’intérêt des paliers profonds devient majeure si l’on se concentre sur le temps total de décompression requis : pour une même durée de décompression, un profil de décompression à palier profond est-il meilleur qu’un palier peu profond conventionnel ? Quelques rares études ont tendance à apporter une réponse négative [10] [14].
L’intérêt du DAN vis-à-vis de l’avantage des paliers profonds a été initialement présenté en 2000 [15]. L’introduction de paliers profonds supplémentaires est apparue avantageuse pour ce qui concerne la production de bulles [16]. Cependant, l’allongement de la durée de décompression était significatif dans ces études. La question est donc la suivante : est-ce le palier en soi qui limite la production de bulles ou est-ce l’augmentation de la durée de décompression associée, requise selon la plupart des algorithmes, qui s’avère plus sûre ?
De plus, si l’on suppose que la production de microbulles peut être minimisée en optant pour une approche avec palier(s) profond(s), quelle est la profondeur optimale pour le premier palier, pour un profil de plongée donné ?
Actuellement, il semble qu’aucune personne ne puisse démontrer si cette solution optimale existe, ainsi que la durée totale de décompression conseillée pour cette voie optimale. Les microbulles se forment d’autant plus abondamment que la diminution de la pression ambiante est importante mais, en même temps, l’élimination des gaz inertes est favorisée par une forte diminution de la pression ambiante. Quel est donc le meilleur compromis ? Et comment les variabilités inter et intra-individuelles impactent cet optimal ? La détection des bulles – en tant que moyen de surveillance du plongeur – devrait aider à répondre à cette question. Une grande base de données sera bientôt disponible à travers le suivi de l’activité des plongeurs loisirs, pour lesquels la production de bulles sera collectée puis analysée (large population, profils de plongée divers, options de plongée variées).
Il semble donc que l’avenir sur cette question est juste devant nous.
References
- Denoble P. Deep stops. Alert Diver Online. Article 255; 2010. – FULL TEXT
- Powell M. Delving deeper into deep stops. Divernet. Reprinted from Diver; July 2018. – FULL TEXT
- Hills BA. A thermodynamic and kinetic approach to decompression sickness. Libraries Board of South Australia; 1966.
- Hugon J. Decompression models: review, relevance and validation capabilities. Undersea and Hyperbaric Medicine. 2014; 41(6): 531-556. – ABSTRACT
- Yount DE, Hoffman DC. On the use of a bubble formation model to calculate diving tables. Aviation Space Environmental Medicine. 1986; 57: 149-156. – FULL TEXT
- Baker EC. Clearing up the confusion about deep stops. – FULL TEXT
- Blatteau J-E,Hugon M, Gardette B, Sainty J-M, Galland F-M. Bubble incidence after staged decompression from 50 or 60msw: effet of adding deep stops. Aviation Space Environmental Medicine. 2005; 76(5): 490-492. – ABSTRACT
- Blatteau J-E,Hugon M, Gardette B. Deep stops during decompression from 50 to 100msw didn’t reduce bubble formation in man. Proceedings Decompression and the Deep Stop; Salt Lake City; 24-25 June 2008. – FULL TEXT
- Pyle R. The importance of deep safety stops: rethinking ascent patterns from decompression dives. SPUMS Journal. 1997; 27(2): 112-115. – FULL TEXT
- Doolette DJ, Gerth WA, Gault KA. Redistribution of decompression strop time from shallow to deep stops increases incidence of decompressions sickness in air decompression dives. Report NEDU TR-1106; Navy Experimental Diving Unit; 2011. – FULL TEXT
- Neuman T. Early observations on the effect of “deep” decompression upon Doppler ultrasonic bubble signals following 210/50 and 170/30 dives. Decompression and the Deep Stop, Salt Lake City; 24-25 June 2008; Proceedings; pp 5-14. – FULL TEXT
- Spisni E, Marabotti C, De Fazio L, Valerii MC, Cavazza E, Brambilla S, Hoxha K, L’Abbate A, Longobardi P. A comparative evaluation of two decompression procedures for technical diving using inflammatory responses: compartmental versus ratio deco. Diving and Hyperbaric Medicine. 2017; 47(1): 9-16. – FULL TEXT
- Consensus statements: statement regarding the efficacity of “deep stops” appropriate for the release to the diving community. Decompression and the Deep Stop, Salt Lake City; 24-25 June 2008; Proceedings; pp 324. – FULL TEXT
- Schellart NAM, Brandt Corstius J-J, Germonpré P, Sterk W. Bubble formation after a 20m dive: deep-stop vs shallow-stop decompression profiles. Aviation Space Environmental Medicine. 2008; 79: 488-494. – FULL TEXT
- Marroni A, Cali Carleo R, Balestra C, Longobardi P, Voellm E, Pieri M, Pepoli R. Effects of the variation of ascend speed and profile on the production of circulating venous gas emboli and the incidence of DCI in compressed air diving. Phase 1. Introduction of extra deep stops in the ascent profile without changing the original ascent rates. DSL Special Project 01/2000. European Underwater and Baromedical Society, EUBS Annual Scientific Meetings; Malta; 14-17 September 2000. – FULL TEXT
- Marroni A, Bennett PB, Cronje FJ, Cali Carleo R, Germonpre P, Pieri M, Bonuccelli C, Balestra C. A deep stop during decompression from 82fsw (25m) significantly reduces bubbles and fast tissue gas tensions. Undersea and Hyperbaric Medicine. 2004; 31(2): 233-243. – FULL TEXT
(1) GF approach coupled to a Bühlmann algorithm can counter-balance this drawback by lengthen the total decompression duration.
